北海康成医药
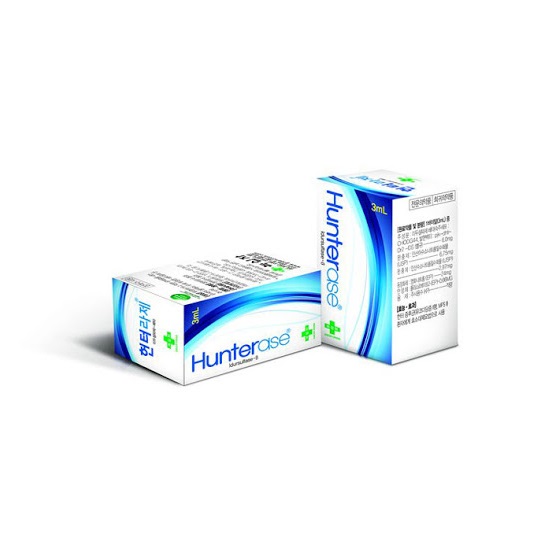
海芮思 艾度硫酸酯酶β注射液
用于确诊的黏多糖贮积症Ⅱ型(MPS Ⅱ,亨特综合征)患者的酶替代治疗。本品尚未在38个月龄以下儿童中开展临床试验。
生产企业:北海康成(北京)医药科技有限公司
通用名称:艾度硫酸酯酶β注射液
品牌名称:海芮思
批准文号:国药准字SJ20200022(前往国家药品监督管理局查看)
用法用量:1.推荐剂量 Hunterase的推荐剂量方案为0.5mg/kg体重,每周一次静脉输注。Hunterase是一种静脉注射浓缩液,使用前须采用100 mL 0.9%氯化钠注射液稀释。每瓶Hunterase含2.0 mg/mL艾度硫酸酯酶β蛋白溶液(6.0 mg),可抽取体积为3.0 mL,仅供一次性使用。 建议使用配备0.2微米(um)过滤器的输液器。 应在1-3小时内完成总体积输注。如果发生输液反应,患者可能需要延长输注时间,但是,输注时间不应超过8小时。在输注开始前15分钟内,初始输注速率应为8 mL/hr。如果输注的耐受性良好,可每15分钟增加8 mL/hr,以在规定时间内给予全部药液量。但是,输注速率不得超过100 mL/hr。如果发生输液反应,根据临床判断,可以减慢输注速率和/或暂停输注,或停止输注。Hunterase不应在输液管内与其他产品同时进行输注。 2.制备和给药说明 使用无菌技术,Hunterase应由专业医护人员进行制备和给药。 根据患者的体重和0.5mg/kg推荐剂量确定应给予的Hunterase总体积和所需药瓶数量。 患者体重(kg) x0.5 mg/kg Hunterase ÷2 mg/mL= Hunterase总体积(mL) Hunterase总体积(mL) ÷3mL/瓶= (药瓶)总数 (四舍五入以确定应抽取的Hunterase总体积所需的整瓶数量。) 目视检查每个小瓶。Hunterase 是-种澄清至轻微乳光、无色溶液。如果小瓶内溶液存在变色情况或颗粒物质,请勿使用该溶液。请勿摇晃Hunterase. 使用100 mL 0.9%氯化钠注射液稀释计算的Hunterase 总体积。稀释后,应轻轻混合输液袋内的溶液,但勿摇晃。如果稀释溶液在制备后8小时内未使用或冷藏,则应将其丢弃。稀释溶液可在冷藏条件下最长储存48小时。
说明书
更多| 【通用名称】 | 艾度硫酸酯酶β注射液 |
| 【药品名称】 | 海芮思 艾度硫酸酯酶β注射液 |
| 【主要成份】 | 活性成份:艾度硫酸酯酶β。 辅料:磷酸氢二钠,磷酸二氢钠,氯化钠,聚山梨酯20,注射用水适量。 |
| 【功能主治】 | 用于确诊的黏多糖贮积症Ⅱ型(MPS Ⅱ,亨特综合征)患者的酶替代治疗。本品尚未在38个月龄以下儿童中开展临床试验。 |
| 【用法用量】 | 1.推荐剂量 Hunterase的推荐剂量方案为0.5mg/kg体重,每周一次静脉输注。Hunterase是一种静脉注射浓缩液,使用前须采用100 mL 0.9%氯化钠注射液稀释。每瓶Hunterase含2.0 mg/mL艾度硫酸酯酶β蛋白溶液(6.0 mg),可抽取体积为3.0 mL,仅供一次性使用。 建议使用配备0.2微米(um)过滤器的输液器。 应在1-3小时内完成总体积输注。如果发生输液反应,患者可能需要延长输注时间,但是,输注时间不应超过8小时。在输注开始前15分钟内,初始输注速率应为8 mL/hr。如果输注的耐受性良好,可每15分钟增加8 mL/hr,以在规定时间内给予全部药液量。但是,输注速率不得超过100 mL/hr。如果发生输液反应,根据临床判断,可以减慢输注速率和/或暂停输注,或停止输注。Hunterase不应在输液管内与其他产品同时进行输注。 2.制备和给药说明 使用无菌技术,Hunterase应由专业医护人员进行制备和给药。 根据患者的体重和0.5mg/kg推荐剂量确定应给予的Hunterase总体积和所需药瓶数量。 患者体重(kg) x0.5 mg/kg Hunterase ÷2 mg/mL= Hunterase总体积(mL) Hunterase总体积(mL) ÷3mL/瓶= (药瓶)总数 (四舍五入以确定应抽取的Hunterase总体积所需的整瓶数量。) 目视检查每个小瓶。Hunterase 是-种澄清至轻微乳光、无色溶液。如果小瓶内溶液存在变色情况或颗粒物质,请勿使用该溶液。请勿摇晃Hunterase. 使用100 mL 0.9%氯化钠注射液稀释计算的Hunterase 总体积。稀释后,应轻轻混合输液袋内的溶液,但勿摇晃。如果稀释溶液在制备后8小时内未使用或冷藏,则应将其丢弃。稀释溶液可在冷藏条件下最长储存48小时。 |
| 【生产企业】 |
功效与作用
更多用药指南
更多注意事项
更多药品口碑
更多药价规格
更多相似功效药品推荐
更多热门药品
知名品牌
搜索热点